- 1
- 2
- 3
- 4
- . . .
- последняя (24) »
соединение откладываемого металла с исходным металлом.
Другая область гальванотехники, которую мы будем описывать в этой книге, называется гальванопластикой; она занимается осаждением металлов толстыми слоями (измеряемыми в миллиметрах), причем осаждение металла производится с целью последующего отделения от покрываемой металлом формы, поэтому крепкого соединения здесь не нужно, изделием является сам отложенный слой металла.
Гальванопластическим способом можно изготовить самые разнообразные художественные изделия. Формы для отложения готовят не только из металла, но и из материалов, не проводящих электричества (например, из гипса, воска, пластических масс), для чего их поверхности делают предварительно электропроводными.
Гальванопластику используют не только в промышленности, где изготовляют этим способом детали машин и приборов, но и в искусстве, где создают копии скульптур и различных художественных изделий из металла.
Гальванопластика является одним из важных методов в полиграфической промышленности, где техника изготовления клише — гальваностереотипов — значительно повышает качество печати книг и иллюстраций. Копирование гравюр на дереве, линолеуме и т. п. до сего времени осуществляется только гальванопластически. С помощью гальванопластики изготовляют также матрицы, которыми прессуют из пластмассы патефонные пластинки.
Области применения гальванопластики в технике обширны и разнообразны: она применяется везде, где точность воспроизведения литья или штамповки оказывается грубой и недостаточной.
Каждый школьник, построив гальванопластическую установку, сумеет не только снимать копии с художественных металлических, гипсовых, пластмассовых и других изделий, но и, умея лепить в пластилине или глине, сможет свои работы затем переводить в металлические изделия гальванопластическим способом.
Гальванопластическим способом можно выполнять множество интересных работ. Делать обычные кружева металлическими и ими украшать деревянные изделия, шкатулки, ларцы и т. п., изготовлять филигранные — ажурные — подстаканники, хлебницы, создавать ювелирные изделия, например броши, браслеты, делать ажурные рамки для фотографий и многие другие красивые изделия.
Гальванопластическим способом можно отделывать изделия из пластических масс и стекла, наращивая металл по заранее нанесенному на них рисунку.
Применять гальванопластику можно и для получения металлических гербариев, делая оттиски на воске с растений и затем наращивая на восковые отпечатки металл. Можно металлизировать гальванопластическим способом цветы, семена и т. п.
Таким образом, занимательная гальванопластика в школе и дома может найти самое широкое применение не только своей занимательностью и практическим изучением электрохимии, но и созданием изделий прикладного и декоративного искусства.
Гальванопластический способ получения художественных изделий в металле отличается от литья тем, что может применяться в условиях лабораторий, физических и химических кабинетов школ, на станциях юных техников, а также в домашних условиях в отведенном и оборудованном для этого месте. Этот способ не требует сложного или недоступного оборудования и материалов; все, что требуется для выполнения гальванопластических работ, вполне может быть найдено среди школьных приборов и реактивов или на станциях юных техников, а при создании гальванопластической мастерской в домашней обстановке может быть приобретено в магазинах (медный купорос, серная кислота).
Описываемые практические работы в «Занимательной гальванотехнике» доступны каждому школьнику, знакомому с элементарными основами химии и физики.
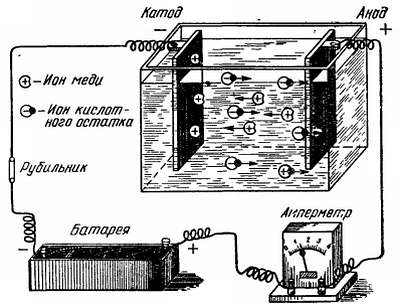
Рис. 1. Гальваническая ванна.
При этом положительно заряженные ионы будут двигаться к отрицательному полюсу (в нашем случае к форме), называемому катодом, а отрицательно заряженные ионы будут двигаться к положительному полюсу, называемому анодом. В гальванопластике для получения медного электролита наиболее распространен медный купорос или кристаллогидрат сульфата меди CuSО4·5Н2О. При прохождении электрического тока через водный раствор сульфата меди ионы меди (Сu2+), являющиеся катионами, несут положительные заряды, а кислотный остаток (SО42-), являющийся анионом, несет отрицательные заряды. В результате разряда на катоде, т. е. в форме, выделяются металлическая медь и водород, а на аноде — кислород. На катоде всегда разряжается металл, а на аноде — кислотный остаток. Поэтому при составлении электролита применяют соли, содержащие ионы осаждаемого металла, а в качестве анода обычно применяют пластины из того металла, который хотят выделить на катоде. М. Фарадей установил, что количества химических веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшего через электролит. Если, например, через электролит пропустить ток силой 1 А в течение 1 ч, то на катоде выделится такое же количество металла, какое выделится при прохождении тока силой 10 А в течение 0,1 ч. М. Фарадей установил также, что количества веществ, выделенные на электродах равными количествами электричества, относятся друг к другу как химические эквиваленты этих веществ. Эквивалентная масса равна атомной массе, деленной на валентность. Так, например, атомная масса серебра равна 107,88, а так как серебро одновалентно, то эквивалентная масса его выражается тем же числом. Атомная масса меди равна 63,57, медь двухвалентна, поэтому эквивалентная масса ее 63,57:2 = 31,78. Для выделения грамм-эквивалента любого металла должно пройти количество электричества, равное 26,8
Законы электролиза
Металлы, применяемые в гальванопластике, выделяются из водных растворов их солей: сульфата меди, железа и других. Молекулы этих солей, растворяясь, подвергаются электролитической диссоциации, т. е. распадаются на ионы, несущие положительные и отрицательные заряды. Вещества, распадающиеся при растворении в воде на ионы, называют электролитами. В технике для простоты электролитом называют самые растворы этих веществ. Если в электролит погрузить два электрода и присоединить их к полюсам источника постоянного тока (рис. 1), например, к гальванической батарее или аккумулятору, причем к отрицательному полюсу подключить форму, проводящую электрический ток, а к положительному — пластину из того металла, из которого мы хотим получить металлическое изделие, то будет происходить электролиз.
Рис. 1. Гальваническая ванна.
При этом положительно заряженные ионы будут двигаться к отрицательному полюсу (в нашем случае к форме), называемому катодом, а отрицательно заряженные ионы будут двигаться к положительному полюсу, называемому анодом. В гальванопластике для получения медного электролита наиболее распространен медный купорос или кристаллогидрат сульфата меди CuSО4·5Н2О. При прохождении электрического тока через водный раствор сульфата меди ионы меди (Сu2+), являющиеся катионами, несут положительные заряды, а кислотный остаток (SО42-), являющийся анионом, несет отрицательные заряды. В результате разряда на катоде, т. е. в форме, выделяются металлическая медь и водород, а на аноде — кислород. На катоде всегда разряжается металл, а на аноде — кислотный остаток. Поэтому при составлении электролита применяют соли, содержащие ионы осаждаемого металла, а в качестве анода обычно применяют пластины из того металла, который хотят выделить на катоде. М. Фарадей установил, что количества химических веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшего через электролит. Если, например, через электролит пропустить ток силой 1 А в течение 1 ч, то на катоде выделится такое же количество металла, какое выделится при прохождении тока силой 10 А в течение 0,1 ч. М. Фарадей установил также, что количества веществ, выделенные на электродах равными количествами электричества, относятся друг к другу как химические эквиваленты этих веществ. Эквивалентная масса равна атомной массе, деленной на валентность. Так, например, атомная масса серебра равна 107,88, а так как серебро одновалентно, то эквивалентная масса его выражается тем же числом. Атомная масса меди равна 63,57, медь двухвалентна, поэтому эквивалентная масса ее 63,57:2 = 31,78. Для выделения грамм-эквивалента любого металла должно пройти количество электричества, равное 26,8
- 1
- 2
- 3
- 4
- . . .
- последняя (24) »